Wasser hat eine Reihe von sehr merkwürdigen Eigenschaften, die mit dem konventionellen molekularen Modell nicht oder nur unzureichend erklärt werden können. Ein paar Beispiele:
- Warum gefriert heißes Wasser schneller als kaltes?
- Wie kann es sein, dass hundert Meter hohe Redwood-Bäume Wasser bis in die höchsten Blätter saugen können? Die Wassersäule müsste unter ihrem eigenen Gewicht zusammenbrechen.
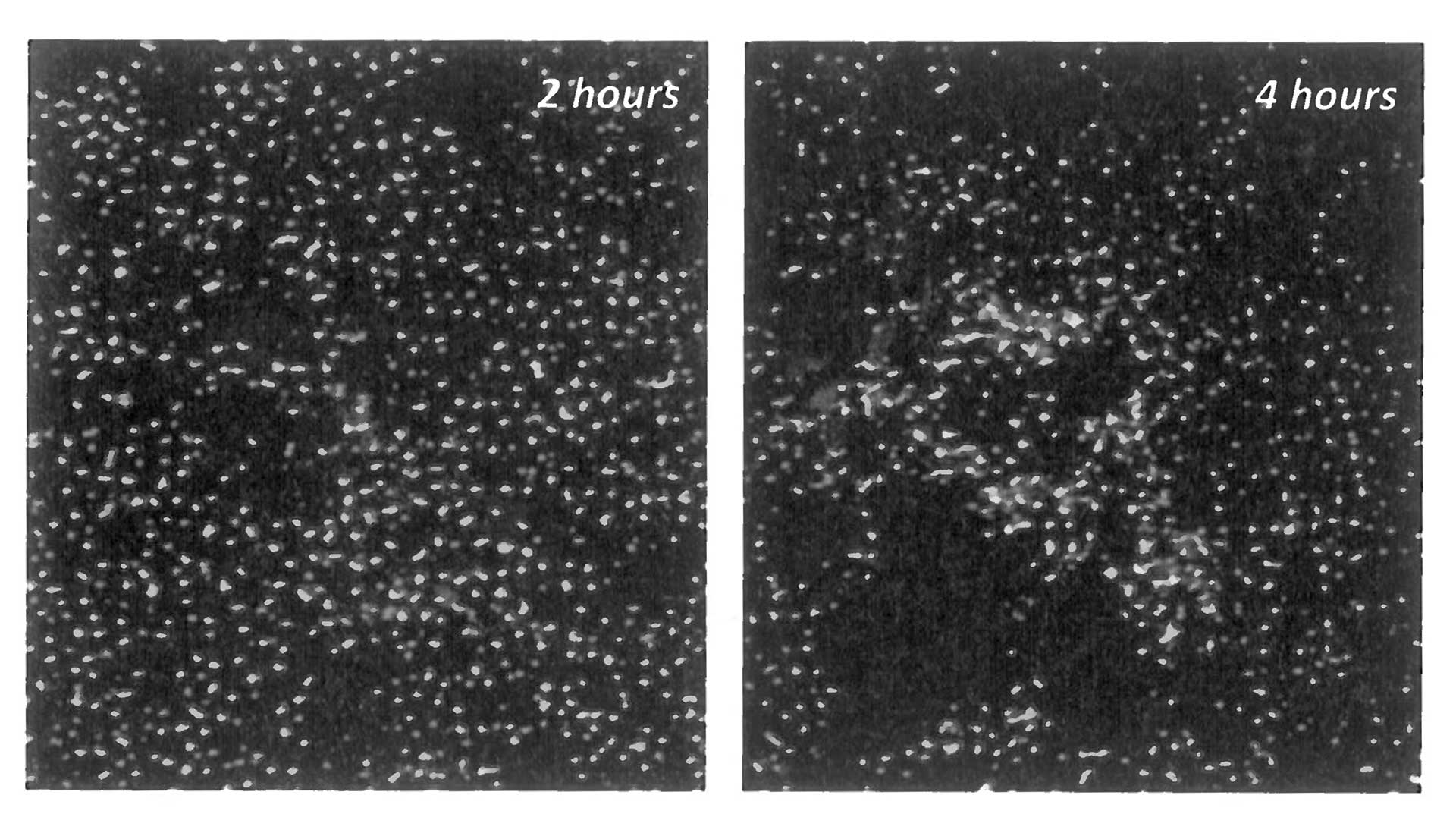
- Wenn Wassertropfen aus einer Pipette auf Wasser prallen, lösen sie sich nicht sofort auf, sondern bilden Kügelchen, die eine Zeitlang über die Oberfläche tanzen. (Abb. 1)
- Warum sinkt der Fuß in trockenem Sand ein, in feuchtem wie am Meeresrand jedoch kaum? Wie schafft es das Wasser, den Sand zusammenzubinden?
- Manche Gele bestehen zu 99,95 Prozent aus Wasser. Warum zerfließen sie nicht, sondern wahren ihre Form?
- Bestimmte Eidechsenarten laufen über eine Wasseroberfläche, ohne zu versinken. Die Oberflächenspannung des Wassers ist aber viel zu gering, um das Gewicht zu tragen. Wie ist das möglich?
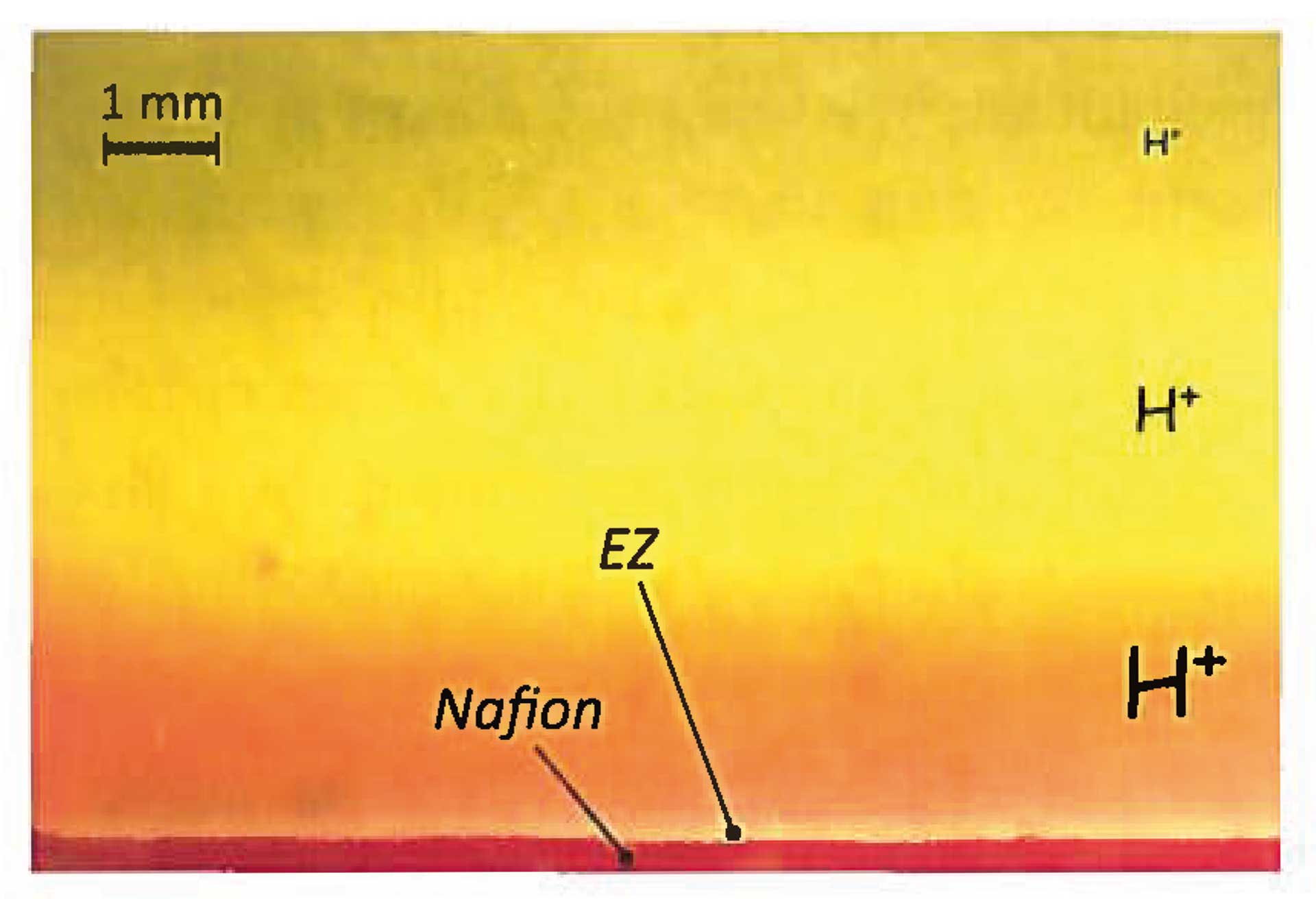
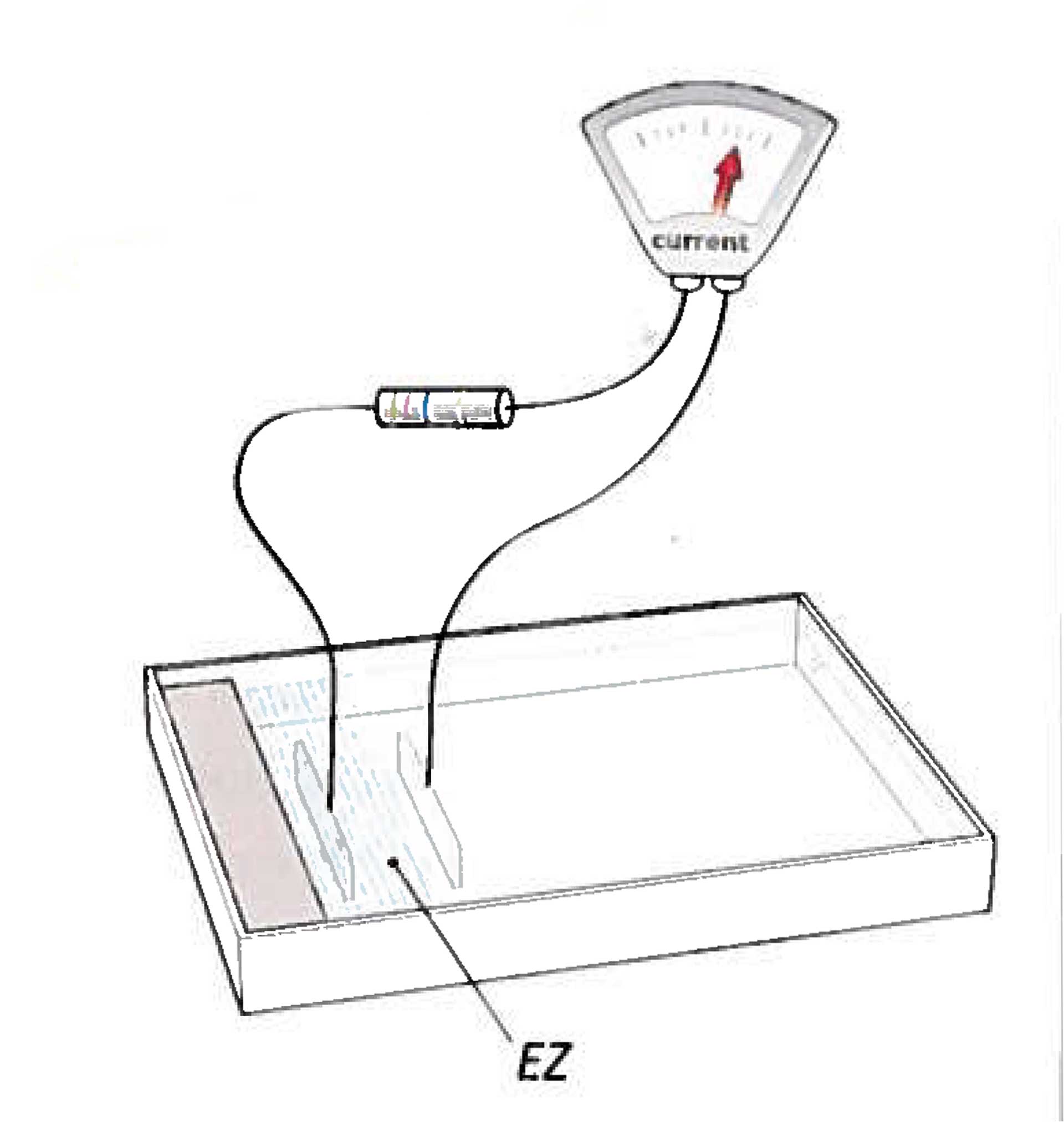
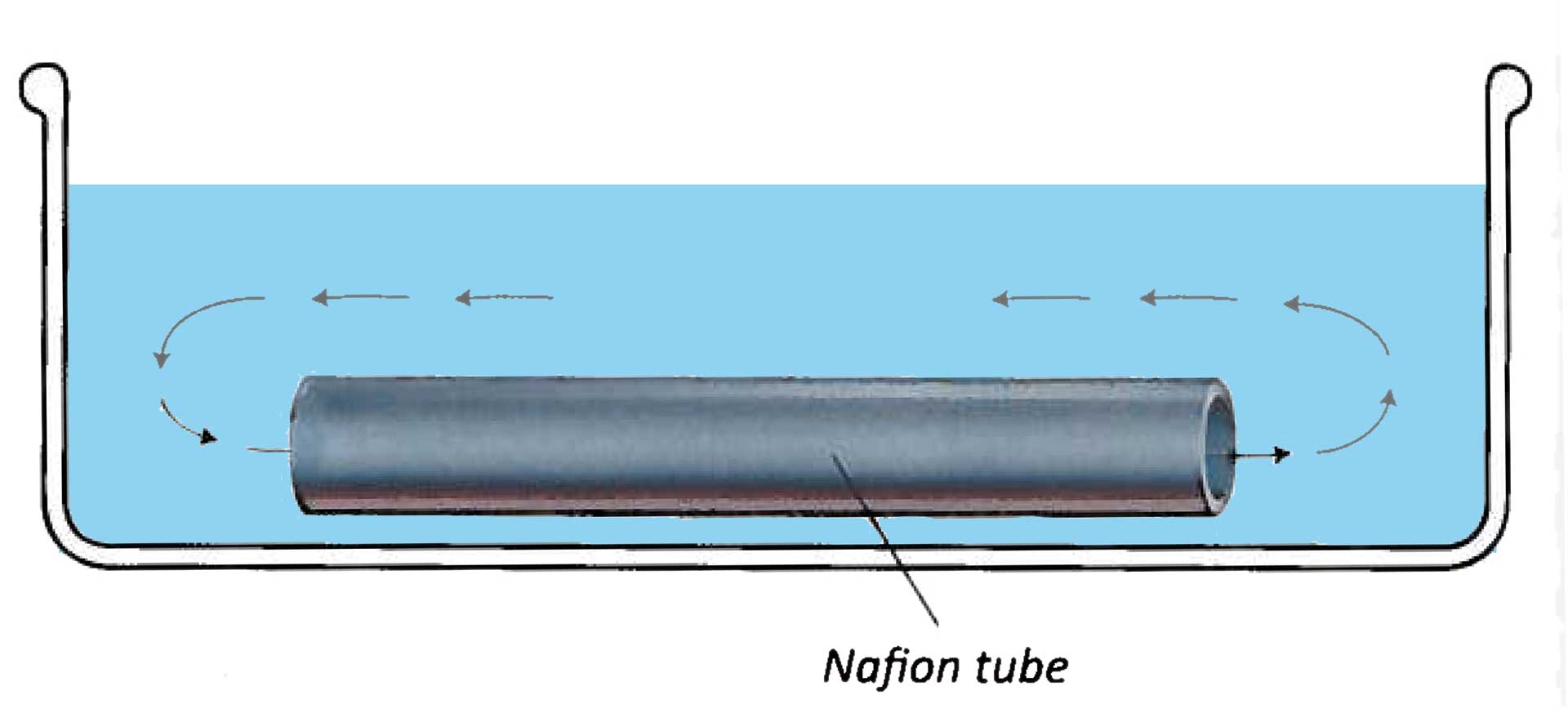
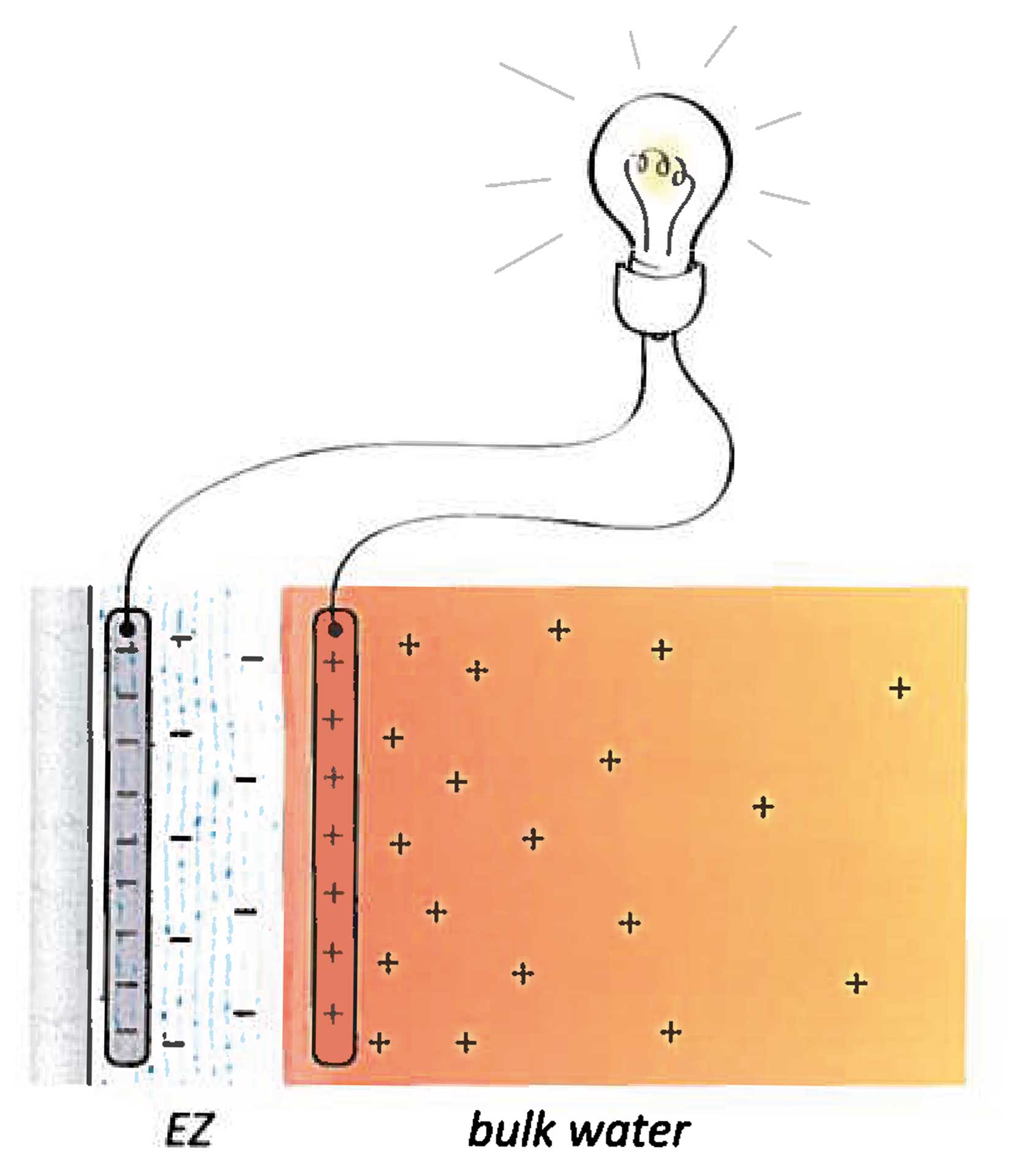
- Legt man an zwei eng benachbarten mit Wasser gefüllten Gläsern eine hohe Spannung an, so bildet sich eine schlauchartige Verbindung aus Wasser zwischen den Gläsern aus, die mehrere Zentimeter überbrücken kann. Die Oberflächenspannung allein wäre für deren Stabilität nicht ausreichend. (Abb. 2)
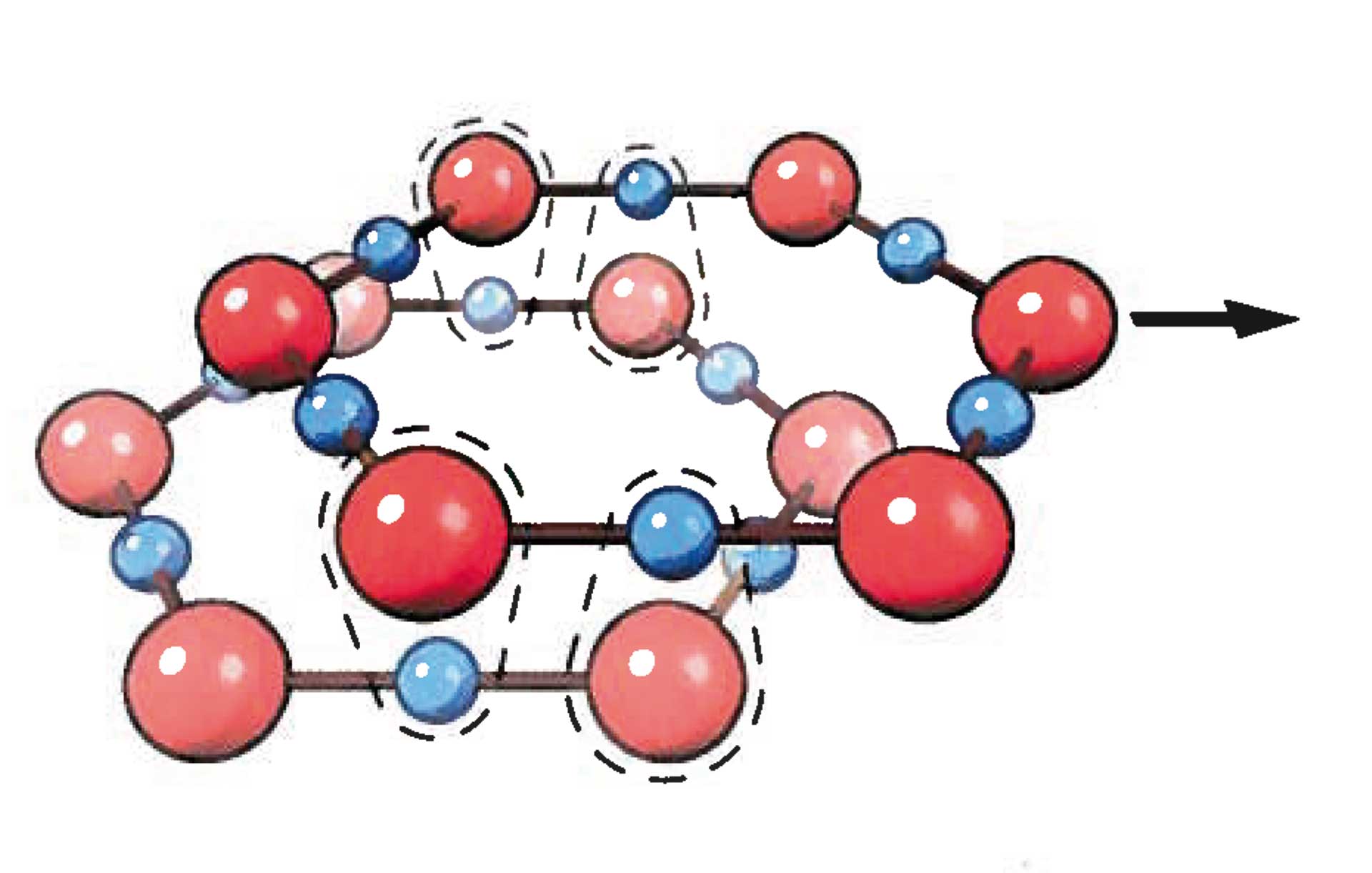
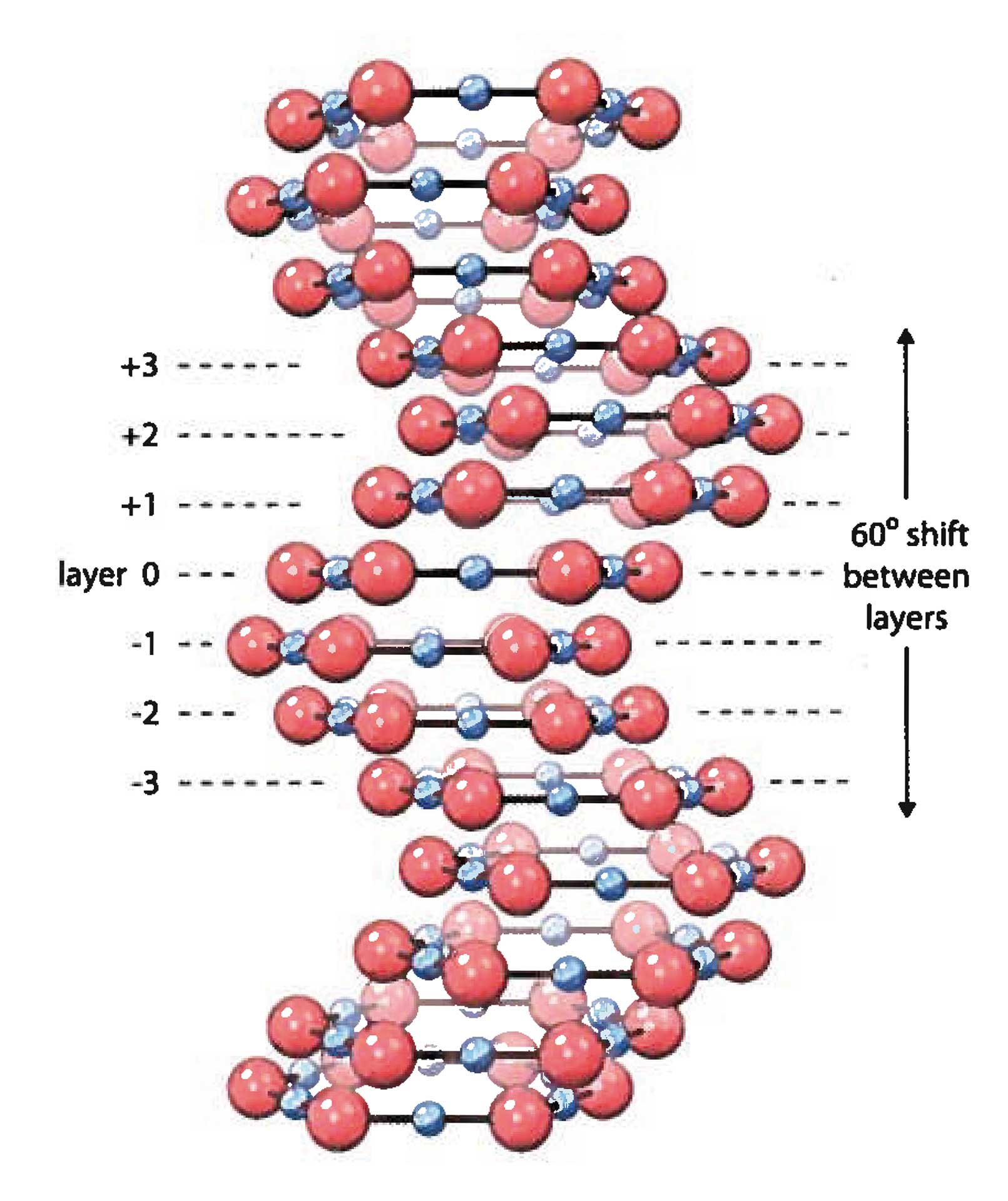
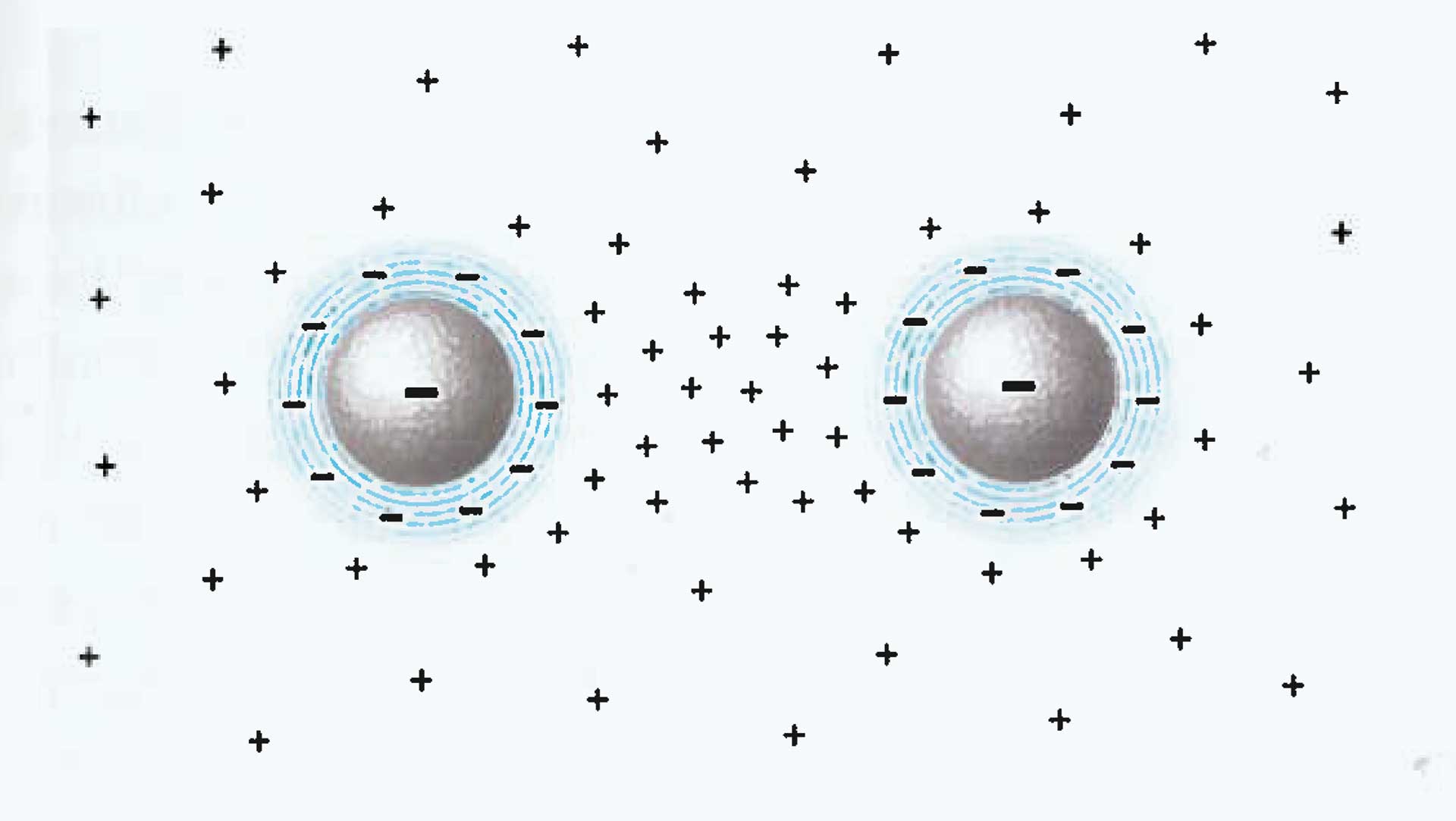
Wasser ist die einzige chemische Verbindung auf Erden, die in der Natur in den drei Phasen gasförmig, flüssig und fest vorkommt. Über diese drei Phasen hinaus akzeptiert die Wissenschaft keine weitere. Aber sie scheint sich zu irren. Wasser hat offenbar eine vierte, bislang unbekannte Phase: als Flüssigkristall, einer, ähnlich wie Eis, hochgradig strukturierten Anordnung der Wassermoleküle, die sich an hydrophilen (wasseranziehenden) Grenzflächen ausbilden kann, insbesondere auch an biologischen. Man nennt es auch Grenzflächenwasser (engl. Interface Water). Zahlreiche Experimente an vielen Forschungseinrichtungen bestärken dieses Modell.